Esteris pret ēteri

Saturs
Esteris un ēteris ir organiskas molekulas ar skābekļa atomiem. Abiem ir ētera saite, kas ir –O-. Esteriem ir grupa –COO. Viens skābekļa atoms ir saistīts ar oglekli ar divkāršu saiti, bet otrs skābeklis ir saistīts ar vienotu saiti. Tā kā tikai trīs atomi ir savienoti ar oglekļa atomu, tam ir trigonāla planāra ģeometrija. Turklāt oglekļa atoms ir sp2hibridizēts.
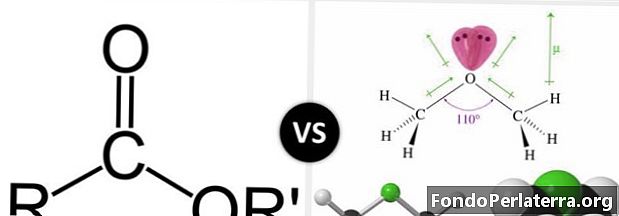
Karboksilgrupa ir plaši izplatīta funkcionālā grupa ķīmijā un bioķīmijā. Šī grupa ir saistītās saimes, kas pazīstama kā acilsavienojumi, vecāka. Acilu savienojumi ir pazīstami arī kā karbonskābes atvasinājumi. Esteris ir tāds karboksilskābes atvasinājums. Estera savienojumam ir oglekļa-karbonil-skābekļa saite, savukārt ētera savienojumam ir oglekļa-skābekļa-oglekļa saite.
Saturs: Atšķirība starp esteri un ēteri
- Kas ir Esters?
- Kas ir ēteris?
- Galvenās atšķirības
- Video skaidrojums
Kas ir Esters?
Esteriem ir vispārēja RCOOR formula. Esteri tiek iegūti, reaģējot starp karbonskābi un spirtu. Esteri tiek nosaukti, vispirms uzrakstot no alkohola iegūtās daļas nosaukumus. Tad nosaukums, kas iegūts no skābās daļas, tiek rakstīts ar galotni -ēda vai -oate.

Kas ir ēteris?
Ēteriem ir funkcionālā grupa ROR, piem. Etoksipropāns. Ēteris ir savienojums, kam ir oglekļa-skābekļa-oglekļa saite. Ēteri var tikt ražoti ar spirtu starpmolekulāru dehidratāciju. Parasti tas notiek zemākā temperatūrā nekā dehidrēšana līdz alēnim.

Galvenās atšķirības
- Esteri ir karbonskābes atvasinājumi, un tiem ir grupa –COO. Ēteriem ir –O- funkcionālā grupa.
- Esterim ir karbonilgrupa blakus -O- skābeklim, bet ēterim tāda nav.
- Esteriem ir tik daudz raksturīgu smaržu.
- Esteri ir viegli hidrolizēti, lai iegūtu spirtu un karbonskābi atšķirībā no ēteriem.
- Esteriem ir funkcionālā grupa RCOOR ar C divkāršu saiti ar vienu no Os un ar vienu saiti ar otru O, piemēram. Etil-etanoāts. Tā kā ēteriem ir funkcionālā grupa ROR, piem. Etoksipropāns
- Ēteris ir savienojums, kam ir oglekļa-skābekļa-oglekļa saite. Ētera piemērs ir etoksilāts. Zemāk esošais savienojums ir laurets 5. No otras puses, esteris ir savienojums, kam ir oglekļa-karbonil-skābekļa oglekļa saite.
- Galvenā īpašība, kas atšķir esteri no ētera, ir to atšķirīgā struktūra. Savienojumam, kas pazīstams kā esteris, piemīt oglekļa-karbonil-skābekļa saite, savukārt ētera savienojumam ir oglekļa-skābekļa-oglekļa saite.
- Esteri ir polāri savienojumi, taču tiem nav iespēju savstarpēji izveidot spēcīgas ūdeņraža saites, jo trūkst ūdeņraža, kas būtu saistīts ar skābekli. Tā rezultātā esteriem ir zemāks viršanas punkts, salīdzinot ar skābēm vai spirtiem ar līdzīgu molekulmasu. Ēteri var tikt ražoti ar spirtu starpmolekulāru dehidratāciju. Parasti tas notiek zemākā temperatūrā nekā dehidrēšana līdz alēnim. Viljamsona sintēze ir vēl viena metode nesimetrisku ēteru iegūšanai.